MEDICAL 6 - ottobre 2014
XIII
ISPEZIONE OTTICA
depositando uno spessore d’oro di 120 nm sopra un
piccolo strato di titanio di 5 nm, che si appoggia a
un substrato di nitruro di silicio di 80 nm. In queste
celle sono stati fatti a matrice duecento fori passanti
con diametro di 200 nm ciascuno e distanza di 600
nm l’uno dall’altro. Sopra e dentro i fori sono deposti
dei biofilm con caratteristiche opportunamente scel-
te per potersi legare ad alcune particolari molecole,
tipiche di talune proteine. I biofilm possono occupa-
re l’intera superficie oppure alcuni gruppi di fori, in
modo da suddividere l’area in diverse zone funziona-
li, ciascuna finalizzata a rilevare particolari categorie
di sostanze. In questo modo
si possono predisporre più
biofilm, per consentire anali-
si multiple sulle gocce di san-
gue ed effettuare molteplici
test medicali in parallelo.
In pratica, la luce del LED il-
lumina contemporaneamen-
te tutti i fori del supporto e
passa attraverso tutti i biofilm
e anche attraverso il sangue
a essi appoggiato e, quindi,
viaggia fino al sensore CMOS
di misura, le cui celle ottiche
catturano le rispettive imma-
gini che vi arrivano proiettate
dai corrispondenti nano fori
dirimpetto. In questo modo,
ciascun gruppo di celle otti-
che rileva un’immagine che
contiene le informazioni sul-
le proprietà biomolecolari
del sangue catturate dai bio-
film corrispondenti. La novi-
tà sperimentata con successo
alla EPFL consiste nello svol-
gere l’analisi sull’intensità
che appare sui CMOS e non
sullo spettro della luce rileva-
ta e ciò semplifica notevolmente l’ingegnerizzazione
della tecnica e la rende notevolmente più economica.
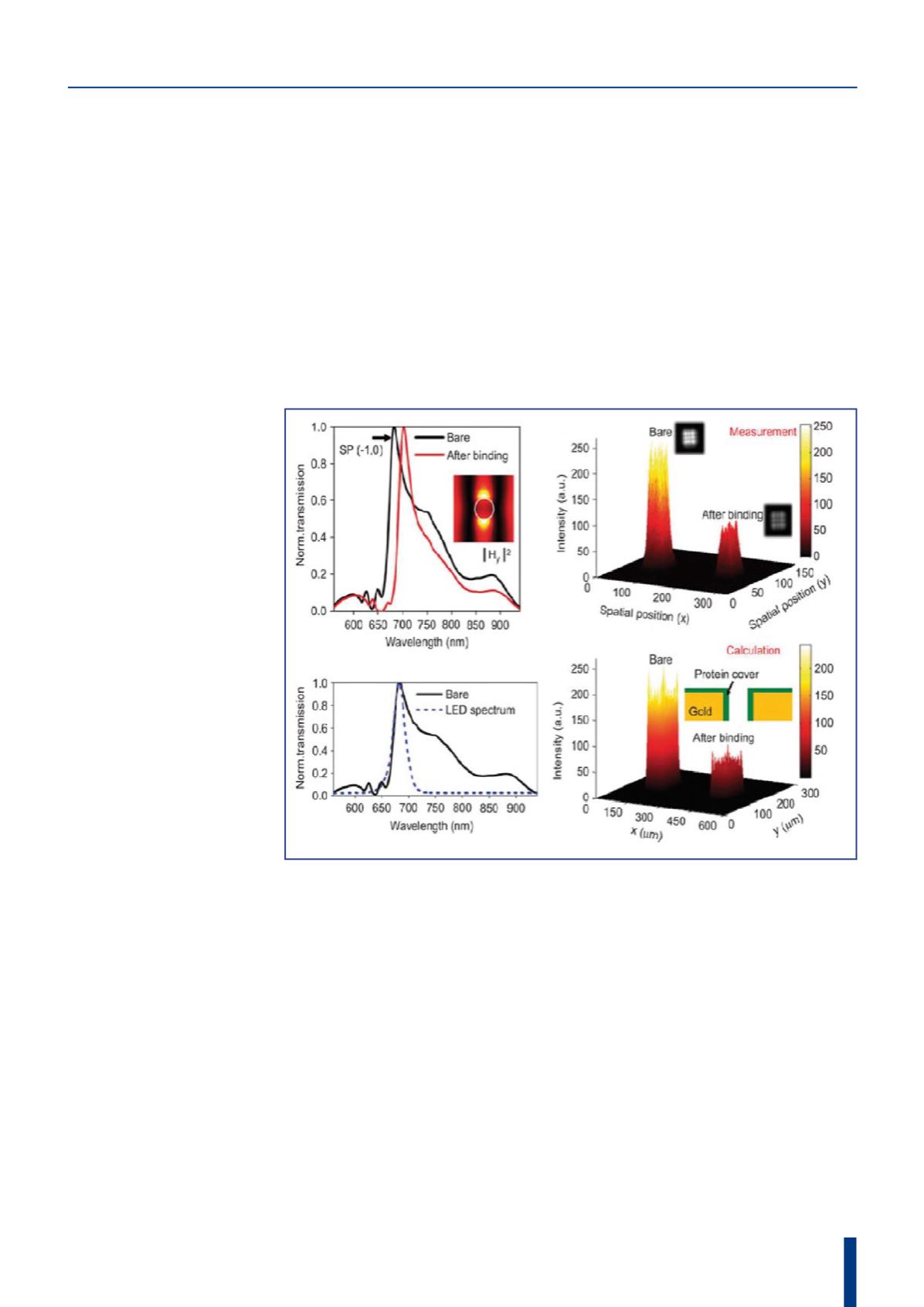
Il metodo di rilevazione è detto a risonanza plasmo-
nica di superficie (o “surface plasmonic resonance”)
perché misura la presenza delle onde superficiali ge-
nerate dalle oscillazioni collettive degli elettroni nelle
interfacce fra l’oro del supporto e il biofilm dielet-
trico, all’arrivo della radiazione luminosa e in questo
modo consente di effettuare una valutazione precisa
della presenza o dell’assenza di una particolare pro-
teina all’interno del campione di sangue attraversato
dalla luce.
È dimostrato, infatti, che attraverso i biofilm la luce
eccita facilmente la risonanza plasmonica delle mole-
cole e perciò consente di attivare le onde superficiali
correlate alla presenza di talune ben specifiche pro-
teine, che possono pertanto essere individuate con
buona selettività. Inoltre, a differenza di molti altri
sistemi diagnostici, non ci sono lenti ottiche per l’e-
qualizzazione della luce emessa dal LED, cosa che vie-
ne invece effettuata con un metodo di ricostruzione
olografica capace di offrire un’elevata risoluzione con
un’area sensibile ottica fino a venti o trenta mm
2
, a un
costo molto più conveniente.
Il biosensore misura, in pratica, la variazione subita
dalla luce del LED quando passa attraverso i nano fori
e poi attraverso le onde plasmoniche che si instaura-
no nel sangue a livello nanometrico, a causa della pre-
senza delle proteine.
A seconda del biofilm deposto sul supporto dorato, si
può decidere quali proteine identificare, ossia quali
onde plasmoniche evidenziare con un’attenta osser-
vazione visiva della luce diffratta catturata dal sensore
a 1 mm di distanza. A causa delle onde, infatti, la luce
subisce per diffrazione una variazione di energia mi-
surabile come spostamento della sua lunghezza d’on-
Fig. 2 – Il sensore ottico rileva le variazioni di lunghezza d’onda e intensità
subite dalla luce che attraversa il campione di sangue a causa delle onde
plasmoniche correlate alla presenza di talune proteine


